Charakter zestawianych ze sobą metali zależy od ich potencjału elektrochemicznego (wyrażonego w V). W określeniu relacji między dwoma metalami pomaga szereg napięciowy metali. Jest to poukładanie metali według potencjału elektrochemicznego ustalonego względem elektrody wodorowej. Elektroda wodorowa ma potencjał równy zero. Przyjmuje się, że metale o potencjale ze znakiem minus są mniej szlachetne, a ze znakiem plus bardziej szlachetne.
Szereg napięciowy wybranych metali przedstawia się następująco:

Szereg jest bardzo przydatny do określenia relacji między dwoma metalami. Anoda zawsze ma niższy potencjał od katody.
Przykład 1. Zasada działania powłoki anodowej – stal powleczona aluminium (stal traktujemy jak żelazo o symbolu Fe).
Zestawiając ze sobą aluminium (Al) i żelazo (Fe), anodą będzie aluminium, a katodą żelazo. Oznacza to, że w odpowiednim środowisku aluminium będzie się roztwarzało chroniąc stal przed korozją,tak długo dopóki całe się nie utleni (roztworzy się).
Przykład 2. Zasada działania powłoki katodowej – stal powleczona srebrem.
Zestawiając żelazo ze srebrem, anodą będzie żelazo (Fe), a katodą srebro (Ag). Żelazo ma niższy potencjał niż srebro dlatego będzie się roztwarzało. Zastosowanie powłoki srebrowej na powierzchni żelaza ma sens tak długo, dopóki nie dojdzie do uszkodzenia mechanicznego pokrycia z powłoki szlachetnej.
Im większa różnica potencjałów między metalami tym szybciej zachodzą procesy elektrochemiczne w ogniwie.
Zadanie 1. Procesy korozyjne będą zachodziły szybciej jeśli zestawimy ze sobą miedź (Cu) z cynkiem (Zn), czy w przypadku połączenia kadmu (Cd) z niklem (Ni)?
Miarą szybkości zachodzących procesów jest siła elektromotoryczna ogniwa (SEM[V]) wyrażona zależnością:
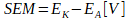
gdzie EK– potencjał katody; EA– potencjał anody.
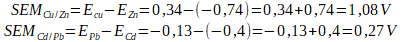
Odpowiedź. Ogniwo złożone z miedzi i cynku będzie szybciej pracowało niż ogniwo składające się z kadmu i ołowiu.
Dla par metali, między którymi SEM wynosi mniej niż 0,05 V, kontakt jest bezpieczny ze względu na prawie niezachodzące reakcje między nimi. Jest to informacja pomocna przy projektowaniu np. połączeń kołnierzowych czy montażu wielu elementów jednej konstrukcji.


