Korozja wżerowa jest specyficzną korozji, która powoduje lokalne ubytki materiału, nazywane wżerami. Zjawisko to jest ściśle związane ze zjawiskiem pasywacji, której ulegają m.in. aluminium, stopy niklu, stale austenityczne, stale stopowe. Pasywacja to proces, który powoduje powstawanie ochronnej warstwy tlenkowej na powierzchni materiału. Zjawisko korozji wżerowej dotyczy nieciągłości tej warstwy i powoduje powstanie niewidocznych ubytków. Jest to rodzaj zniszczenia miejscowego, występującego w postaci plam i wżerów sięgających wgłąb materiału. Wżery są o tyle niebezpieczne, że często ubytki mogą być nie widoczne gołym okiem, a postępujące, lokalne zniszczenia, mogą doprowadzić do perforacji elementu. Ten rodzaj korozji zachodzi w różnych środowiskach, najczęściej jednak w otoczeniu jonów halogenkowych, czyli F-, Cl-, Br-, I-. Chlorki to związki wszechobecne i wszędobylskie, zawarte w wodzie morskiej i glebie. Metody wykrywania i zapobiegania korozji wżerowej znacząco poszły naprzód (wykorzystanie takich technik jak elipsometria czy rentgenowska fotospektroskopia), jednak mimo to złożoność tego zjawiska nie została do końca zbadana.

Powstawanie korozji wżerowej
Istnieją różne rodzaje materiałów, które ulegają pasywacji. Niektóre z nich pasywują samoczynnie, w wyniku działania określonego środowiska, inne z kolei można „zmusić” do wytworzenia warstwy pasywnej. Warstwę pasywną można wytworzyć w wyniku procesu chemicznego lub elektrochemicznego. Pasywacja chemiczna np. chromu polega na użyciu odczynnika trawiącego (czyszczącego), a następnie nałożeniu preparatu chemicznego na bazie kwasu azotowego, który wytworzy warstwę pasywną. Pasywacja elektrochemiczna, polega na wykorzystaniu urządzeń do elektrolizy chemicznej, które wykorzystuje prąd, temperaturę i elektrolit do wytworzenia warstewki tlenków. Przykładem naturalnej pasywacji może być wytworzenie się patyny na stopach miedzi (charakterystycznego zielonego nalotu). Ciekawostką jest, że przy pasywacji aluminium, możemy dodać barwniki, które zmienią kolor warstwy ochronnej.
Na korozję wżerową narażone są szczególnie miejsca nieciągłości warstwy pasywnej, tj. wtrącenia, niedoskonałości materiału, uszkodzenia mechaniczne.
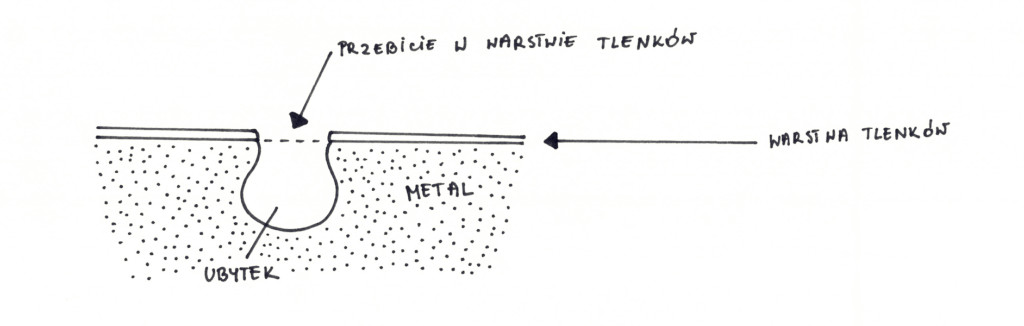

Obecność jonów halogenkowych wewnątrz wżeru powoduje niekorzystne warunki do odbudowy warstwy ochronnej. Wewnątrz wżeru, w wyniku działania jonów aktywujących (jony chlorkowe), tworzy się anoda, a na zewnątrz dochodzi do reakcji katodowej (redukcja tlenu) w obecności czynników utleniających. Można powiedzieć, że dalsze rozrastanie wżeru postępuje już samoczynnie, bo samo jego wytworzenie stwarza idealne warunki do dalszego wzrostu. Dodatkowo niekorzystny stosunek dużej katody do małej anody zwiększa szybkość korozji.
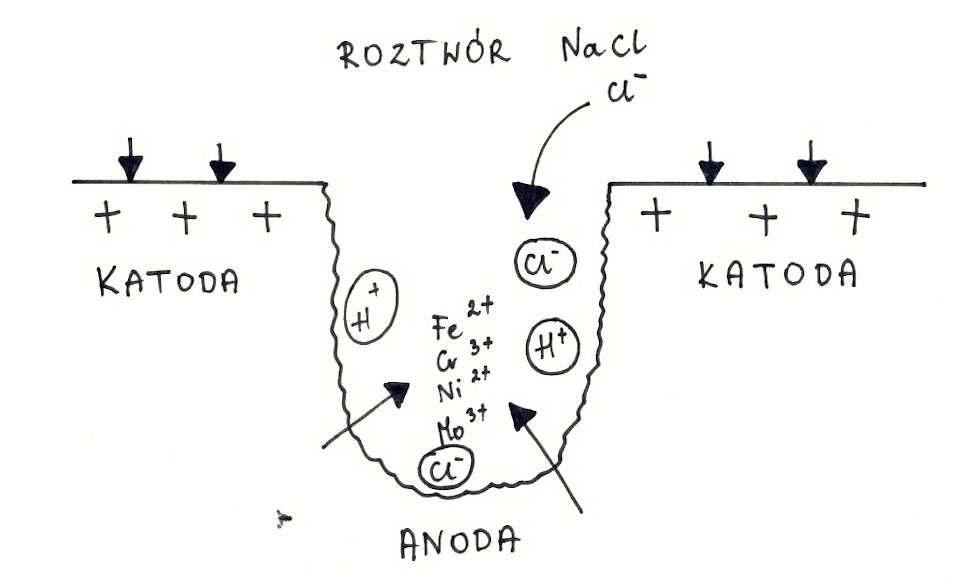


Czynniki wpływające na korozję wżerową
Dwa główne czynniki wpływające na powstanie korozji wżerowej to:
- skład materiału konstrukcyjnego,
- skład środowiska.
Gdy mówimy o składzie materiału, mamy na myśli ilość pierwiastków stopowych zawartych w stali. Stwierdzono, że bardziej odporne na korozję wżerową są stale zawierające duże ilości chromu, niklu, molibdenu oraz azotu. Stale zawierające wysoką ilość węgla mogą być bardziej narażone na opisywany typ korozji, podobnie jak te zawierające dużą ilość siarki i selenu. Warto również zawrócić uwagę na wpływ jednorodności struktury materiału na korozję wżerową. Prawdopodobieństwo jej wystąpienia na powierzchni polerowanej jest znacznie mniejsze niż na powierzchniach szlifowanych lub nie poddanych obróbce. Ciekawym przykładem jest wykorzystanie stali austenitycznej do budowy statków. Przeprowadzono badania wskazujące, że ziarnista budowa stali austenitycznej może prowadzić do zapoczątkowania korozji wżerowej, a dodatkowo do rozpoczęcia korozji międzykrystalicznej. Stąd też i nie buduje się kadłubów statków ze stali nierdzewnych, bo warunkach morskich (rozpuszczona sól – chlorki) będzie dochodziło do zaatakowania korozyjnego. Niemniej w Polsce wykonano kadłub ze specjalnego gatunku stali austenitycznej dla ORP Kormoran. W tym wypadku, chodziło o wykorzystanie niskiej przenikalności magnetycznej (kadłub niemagnetyczny) w celu uniknięcia np. detonacji miny czułej na magnetyki.
Drugim, niemniej ważnym elementem jest skład środowiska, pH, temperatura oraz szybkość przepływu roztworu. Oprócz jonów chlorkowych, niekorzystny wpływ mają silne depolaryzatory, takie jak: Fe3+, Cu2+, Hg2+. Obecność niektórych anionów hamuje powstawanie korozji: NO3-, SO42-,ClO4-. Wzrost temperatury może wpływać negatywnie na odporność materiału na korozję wżerową. Jeśli chodzi o przepływ medium, ciężko jednoznacznie stwierdzić czy jego wpływ jest pozytywny czy negatywny. Niektóre źródła podają, że zwiększenie szybkości elektrolitu całkowicie eliminuje problem korozji wżerowej, inne natomiast, że zmienia się charakter zaatakowania. Przy małej szybkości przepływu, tworzy się mniejsza ilość większych wżerów, odwrotnie przy dużych prędkościach.
W sytuacji, gdy mamy do czynienia z wieloma zmieniającymi się czynnikami środowiskowymi, należy podejść indywidualnie do każdego przypadku analizując wszystkie składowe: skład materiału oraz wszystkie czynniki środowiskowe.
Ocena odporności stali na korozję wżerową
Aby umożliwić ocenę materiału pod kątem odporności na korozję wżerową wprowadzono pojęcie PREN (Pitting Resistant Equivalent Number). Jest to wzór umożliwiający określenie podatności materiału na korozję wżerową.
PREN = %Cr + 3,3*%Mo + 16*%N,
gdzie:
%Cr – procentowa zawartość chromu,
%Mo – procentowa zawartość molibdenu,
%N – procentowa zawartość azotu.
Przykładowo:
| rodzaj stali | %Cr | %Mo | %N | PREN |
| 1.4404 | 16,5-18,5 | 2-2,5 | max. 0,11 | 23,1 – 28,51 |
| 1.4301 | 17,5-19,5 | 0 | 0 | 17,5 – 19,5 |
Jak widać wzór ten, ściśle związany jest ze składem stopu, głównie z ilością pierwiastków wpływających na odporność na korozję wżerową. Jest to parametr, który służy do porównania kilku rodzajów stali na początkowym etapie projektowania. Jest tylko wskazówką, bo nie uwzględnia czynników środowiska.
Wykrywanie korozji wżerowej
Przykładem wykrywania korozji wżerowej może być zanurzenie elementu w roztworze z żelatyny i feroksylu, który służy do wykrywania korozji elektrochemicznej żelaza. Odczynnik ten w obecności jonów Fe2+ barwi się na niebiesko, jest to kolor zwany błękitem Turnbulla (błękitem pruskim). Gdy dochodzi do wytwarzania jonów OH- odczynnik przybiera kolor różowy. Niebieski kolor mówi nam o obszarze anodowym, a różowy o katodzie.

Zapobieganie korozji wżerowej
Pierwszym elementem jest odpowiedni dobór stali konstrukcyjnej do warunków, w których będzie pracować. Już na etapie projektowania należy wziąć pod uwagę ilość soli w środowisku, pH, przepływ medium itp. Kolejnym sposobem jest modyfikacja środowiska poprzez dodanie inhibitorów korozji. Można również utrzymywać zakres potencjałów na bezpiecznym poziomie, poprzez ochronę elektrochemiczną. Wzrost wżeru może być zatrzymany wtedy, gdy powierzchnia wżeru zostanie ponownie spasywowana to znaczy: potencjał wżeru i stopu uzyskają taką samą wartość.
Jak widać, zjawisko korozji wżerowej jest tematem rozległym i złożonym. Przy projektowaniu konstrukcji, która wykorzystuje materiały omówione w tym artykule warto zwrócić uwagę, czy będzie ona narażona na ten rodzaj korozji. Jest to zjawisko niebezpieczne szczególnie w przemyśle petrochemicznym i chemicznym, gdzie mamy do czynienia z wysokimi temperaturami, przepływem medium i stężonymi kwasami. Korozja wżerowa może prowadzić do niewidocznych gołym okiem uszkodzeń oraz do dalszego rozwoju korozji szczelinowej i międzykrystalicznej.
Dla dociekliwych, poniżej przedstawiamy chemiczne spojrzenie na temat pasywacji oraz korozji wżerowej. Pasywację metali i stopów charakteryzuje krzywa polaryzacji, wyznaczana w urządzeniu zwanym potencjostatem. Krzywa ta określa zależność prądu polaryzacji i potencjału elektrody względem elektrody odniesienia. Badaną płytkę ze stali węglowej odtłuszczamy, trawimy w 10% HCl, płuczemy w wodzie bieżącej i destylowanej, suszymy. Do potencjometru podłączamy badaną płytkę wraz z elektrodą odniesienia NEK (elektroda kalomelowa) oraz płytką pomocniczą (siatka platynowa). Zmieniamy potencjał elektrody o około 20mV i badamy natężenie prądu po każdej zmianie. Warto również wizualnie obserwować powierzchnię elektrody, bo wnikliwy obserwator zauważy procesy zachodzące w układzie.
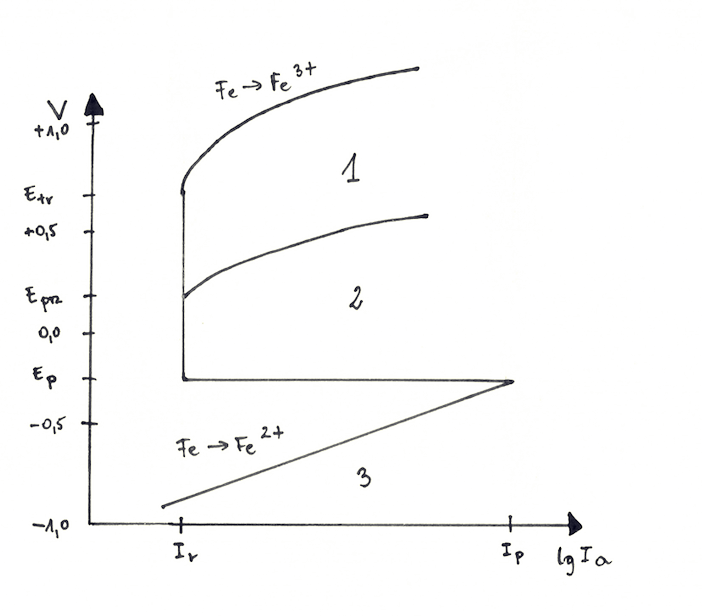
Ep – potencjał pasywacji,
Eprz – potencjał przebicia,
Etr – potencjał przepasowywania,
Ip – prąd pasywacji,
Ir – prąd w zakresie pasywnym.
W zakresie oznaczonych numerami, dochodzi do poszczególnych procesów: 1 – obszar korozji ogólnej przepasowywania, 2 – obszar korozji lokalnej (wżerowej) w obecności jonów chlorkowych, 3 – obszar korozji ogólnej.
W układzie, przy braku potencjału zewnętrznego, ustala się pewien potencjał korozyjny, który prowadzi do samorzutnego roztwarzania się żelaza (obszar 3). Gdy zwiększymy potencjał żelaza, przyspieszamy procesy utleniania. Wpływ takiego działania możemy obserwować poprzez zmianę prądu (logIa). Jak widać gęstość prądu wzrasta stopniowo wraz ze wzrostem potencjału aż do miejsca oznaczonego prądem pasywacji. Po osiągnięciu potencjału pasywacji, wartość prądu znacząco spada, obniża się szybkość roztwarzania żelaza, co związane jest z tworzeniem się warstwy pasywnej. Warstwa ta istnieje do osiągnięcia potencjału transpasywacji, gdzie ponownie rozpoczyna się roztwarzanie żelaza do Fe3+ i dochodzi do wydzielania się tlenu.
Aby wystąpiła korozja wżerowa konieczny jest tzw. „potencjał przebicia”, który na wykresie zawarty jest pomiędzy obszarem 1 a 2. Jest to wartość potencjału, w której zaczynają pojawiać się wżery. Ponieważ jest on niższy od potencjału przepasowywania, leży więc w obszarze pasywnym metalu.


